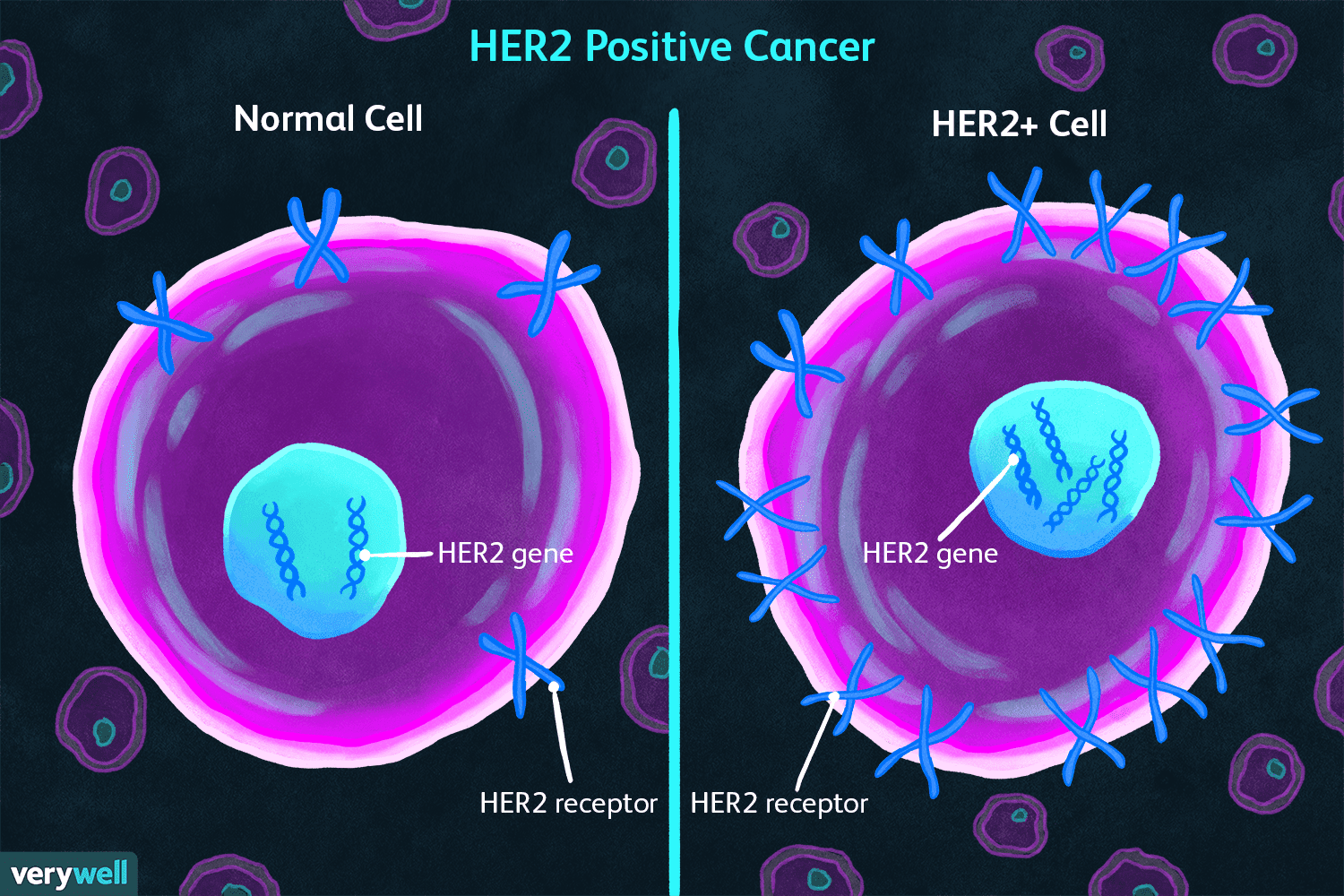
Dagli studenti per gli studenti: il recettore HER-2 e il suo ruolo nei tumori
Il recettore HER-2 (Human Epidermal Growth Factor Receptor 2) è un recettore transmembrana che fa parte della famiglia dei recettori epidermici dei fattori di crescita,…



Il recettore HER-2 (Human Epidermal Growth Factor Receptor 2) è un recettore transmembrana che fa parte della famiglia dei recettori epidermici dei fattori di crescita,…
Recentemente nel campo dell’oncologia sono stati introdotti dei nuovi promettenti farmaci detti “agnostici“. Come funzionano? Qual è la differenza rispetto agli altri farmaci attualmente in…

Spesso le parole nucleare o radiazioni ci fanno paura e vengono viste con scetticismo nell’immaginario collettivo. La scienza ci dice tuttavia che sono dei fedeli…
Chi non ha mai usato o sentito parlare di aspirina? Parliamo di uno dei farmaci più utilizzati su scala mondiale, usato per le sue capacità…

l Nobel per la Chimica quest’anno è stato “vinto a parimerito” dalla chimica americana Jennifer A. Doudna e dalla biochimica francese Emmanuelle Charpentier, per lo sviluppo di CRISPR Cas9, una tecnica di editing…

L’associazione più immediata che operiamo quando ci viene menzionata la parola “analisi”, in ambito medico, è certamente il prelievo di sangue. In pochi penseranno che…
Una delle maggiori problematiche della medicina moderna è la diagnosi precoce dei tumori maligni: identificarli in uno stadio iniziale corrisponde a dare ottime chance di…
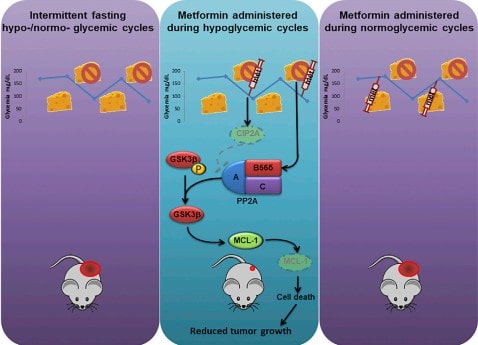
La ricerca percorre ogni giorno strategie diverse nel tentativo di sconfiggere il cancro. Un passo in avanti molto promettente è emerso da un ragionamento tanto…

Tra articoli speculativi e dati scientifici sfuggenti, cerchiamo di fare chiarezza. È una questione estremamente attuale. Basti pensare al caso di Roberto Romeo, tecnico di…