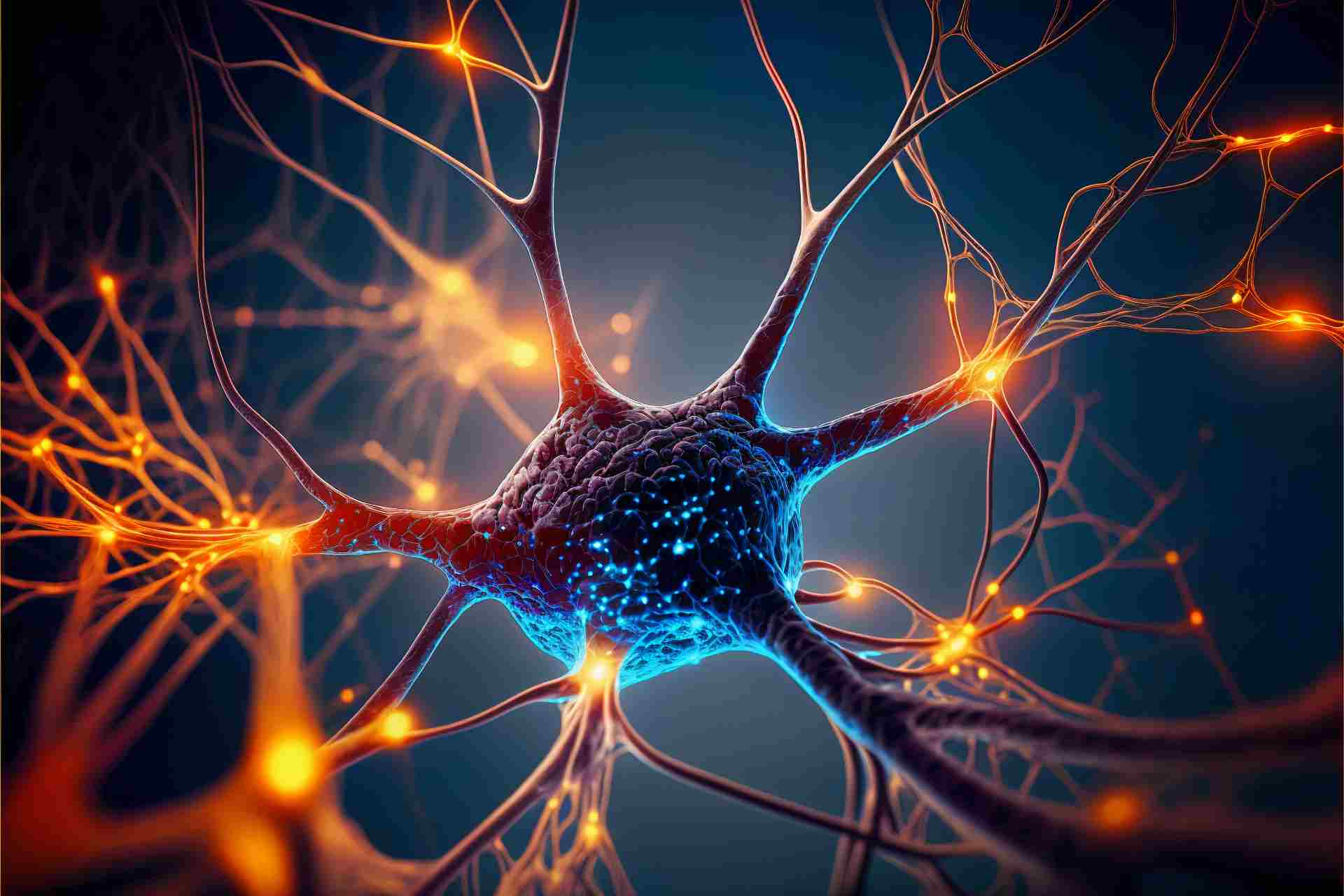
Rigenerazione del sistema nervoso: le applicazioni della nanomedicina
La medicina non ha mai smesso di progredire, poiché la scoperta di nuove malattie cammina di pari passo con le strategie intraprese per curarle, per…



La medicina non ha mai smesso di progredire, poiché la scoperta di nuove malattie cammina di pari passo con le strategie intraprese per curarle, per…
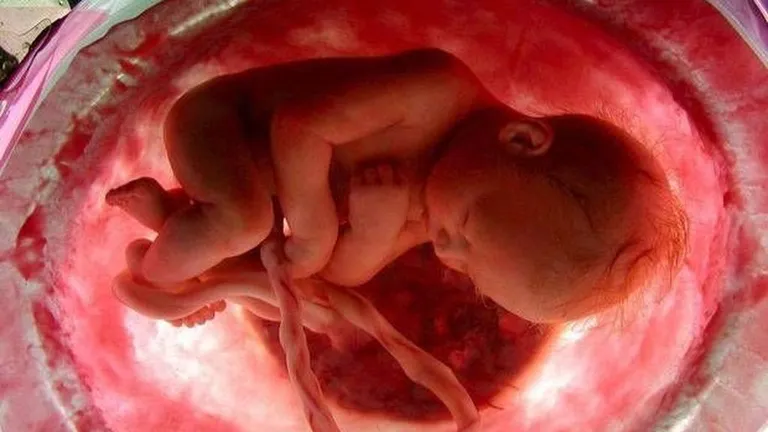
L’intera gestazione spesso viene scambiata da molti per un miracolo. Questa in realtà viene resa possibile, dalla fecondazione al parto, grazie a dei processi chimico-fisici…

La medicina si avvicina sempre di più al suo obiettivo principale: comprendere ‘’la macchina’’ quasi perfetta qual è il corpο umano e scoprire nuovi modi per poterla…
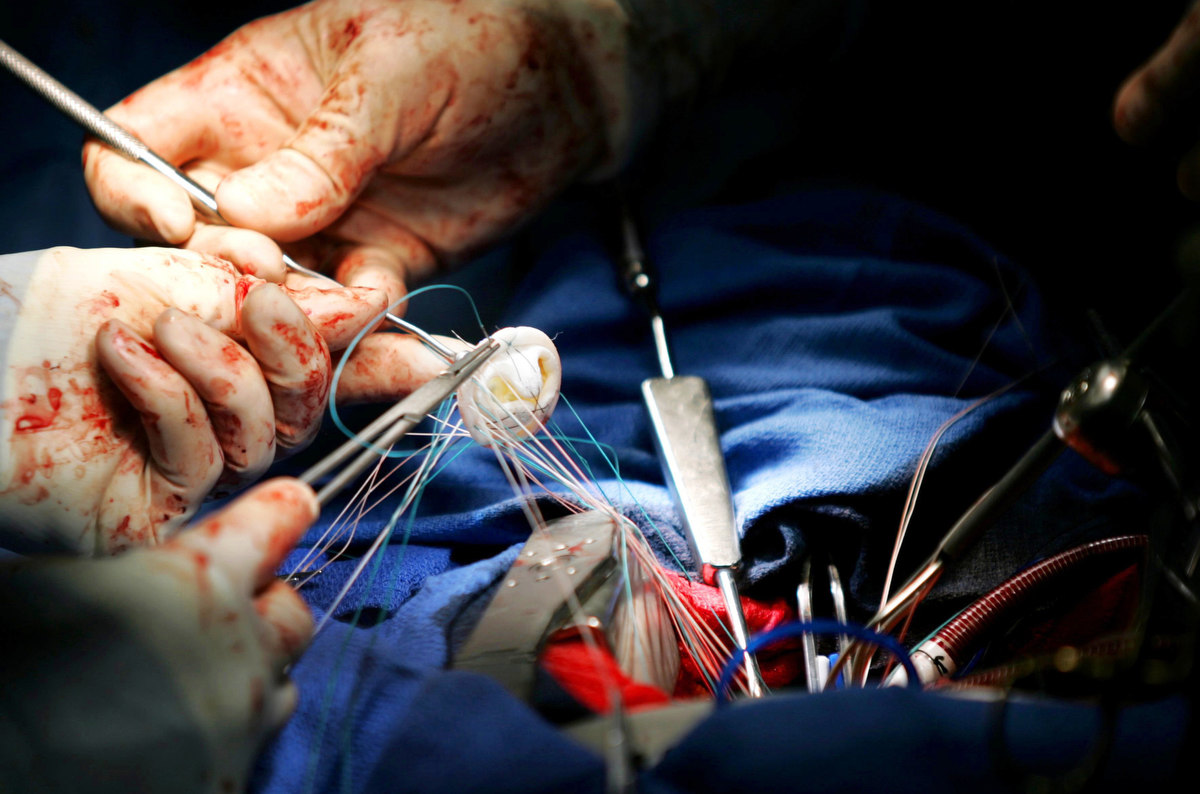
La scienza con i suoi passi da gigante, ci apre la vista a nuove frontiere. Dal 1967 ad oggi abbiamo assistito, grazie all’intraprendenza ed alla…
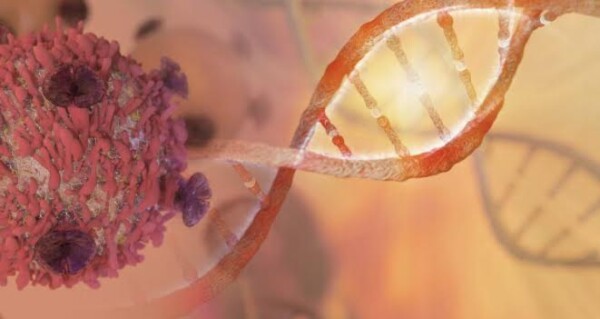
E’ possibile prevedere l’insorgenza del cancro? Fattori di rischio e insorgenza di cancro Il cancro è una malattia genetica? Età: un possibile fattore predittivo? Cell…