
Il gene dei serial killer: la criminalità è una questione genetica?
Sin da sempre nella storia dell’uomo, scienziati, psichiatri e professionisti di ogni tipo, hanno cercato una ragione dietro crimini atroci come l’omicidio. Se fino a…



Sin da sempre nella storia dell’uomo, scienziati, psichiatri e professionisti di ogni tipo, hanno cercato una ragione dietro crimini atroci come l’omicidio. Se fino a…

Il 13 marzo 2021, in occasione della Giornata delle Malattie Neuromuscolari 2021, associazioni laiche e scientifiche (AIM e ASNP) hanno portato avanti un progetto volto…

l Nobel per la Chimica quest’anno è stato “vinto a parimerito” dalla chimica americana Jennifer A. Doudna e dalla biochimica francese Emmanuelle Charpentier, per lo sviluppo di CRISPR Cas9, una tecnica di editing…
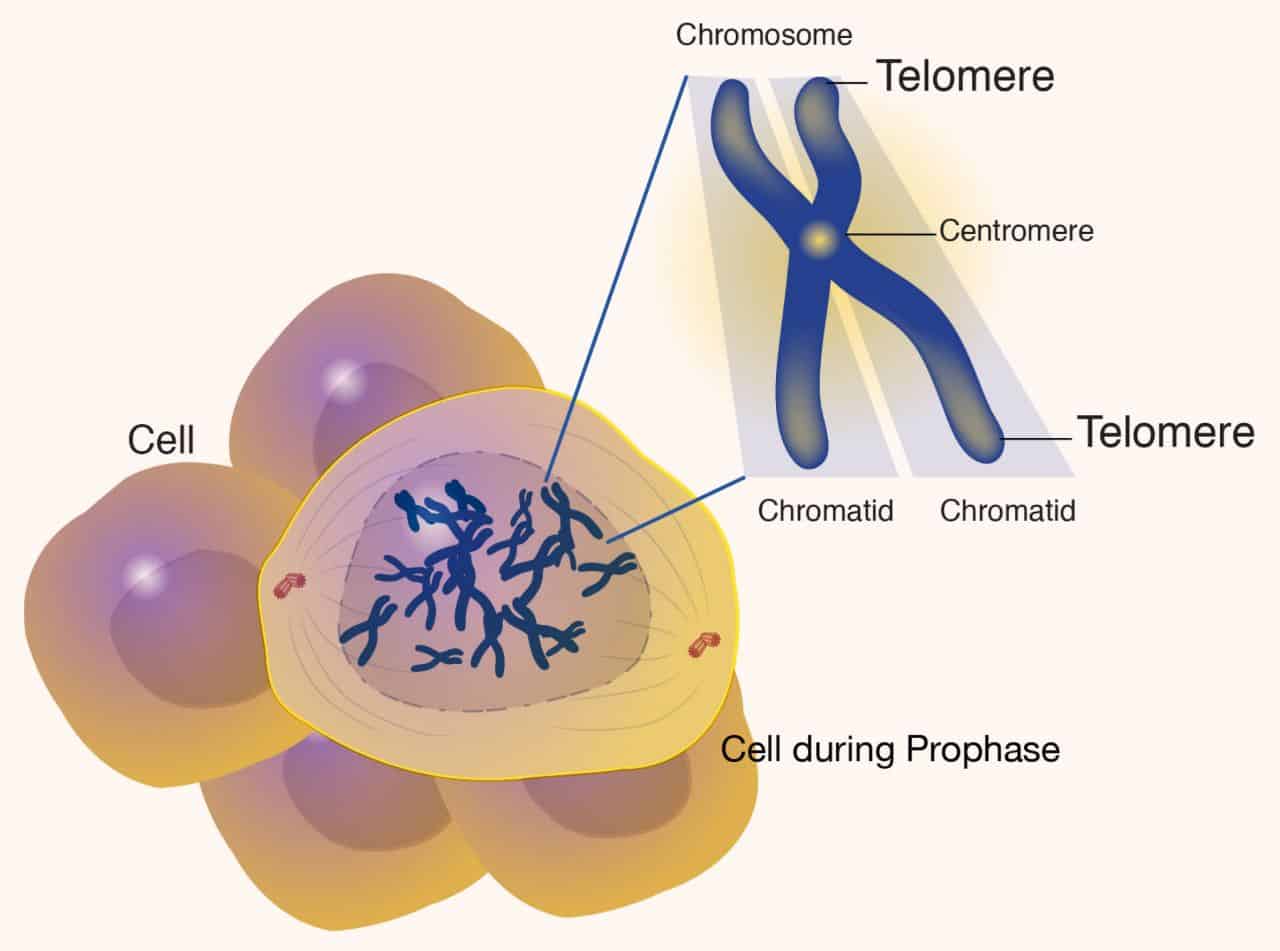
Progresso tecnologico e speranze future per le patologie incurabili. Un team di scienziati statunitensi e britannici ha prodotto la sequenza di DNA senza interruzioni, dall’inizio…
Il terzo gemello è un’opera dello scrittore britannico Ken Follet pubblicata nel 1996. L’autore ci propone un accattivante thriller che affascinerà il…