L’editing genetico: il futuro per malattie su base genetica?
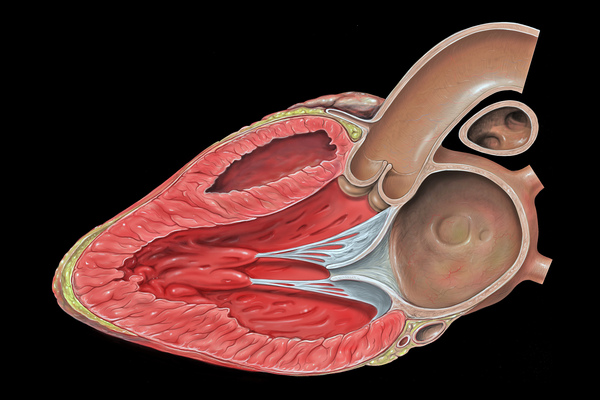
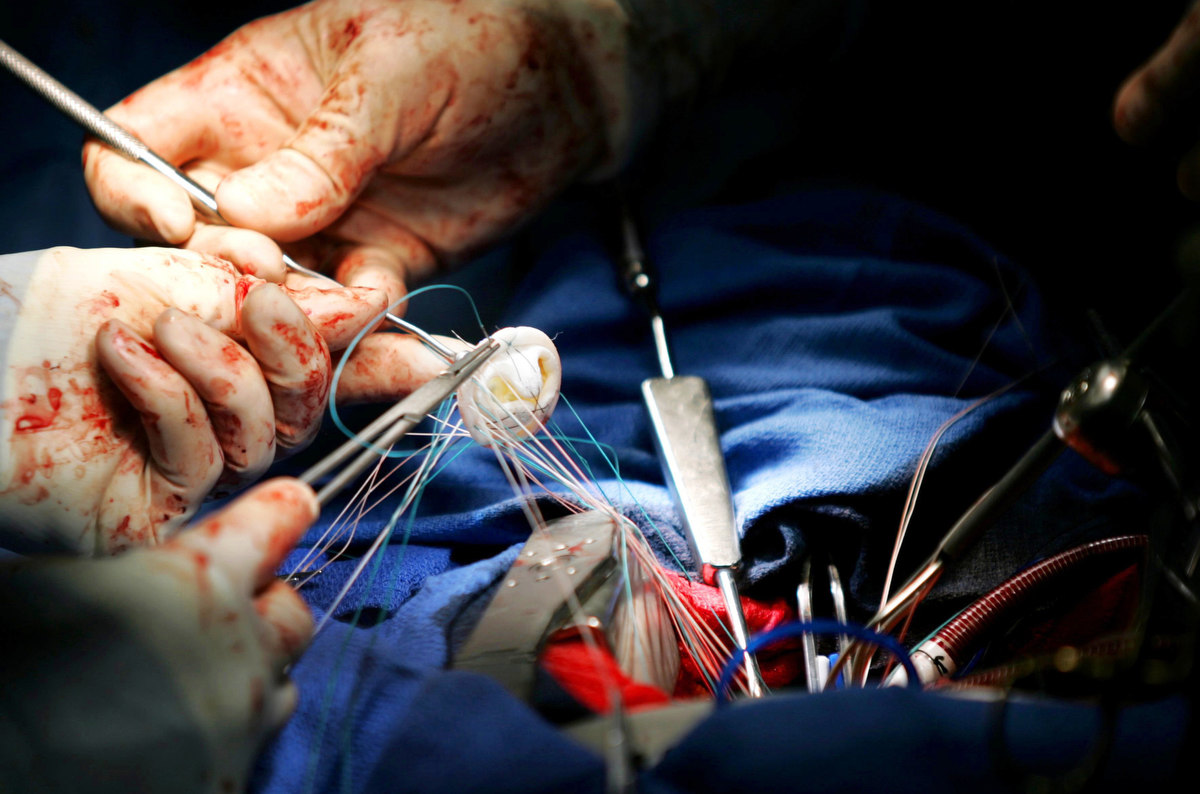
Introduzione Come malattie cardiovascolari annoveriamo: infarto del miocardio, ischemia e scompenso al livello cardiaco. Infarto del miocardio è causato principalmente da un’ostruzione di quello…