È possibile diagnosticare un tumore con un prelievo di sangue?
Una delle maggiori problematiche della medicina moderna è la diagnosi precoce dei tumori maligni: identificarli in uno stadio iniziale corrisponde a dare ottime chance di…



Una delle maggiori problematiche della medicina moderna è la diagnosi precoce dei tumori maligni: identificarli in uno stadio iniziale corrisponde a dare ottime chance di…
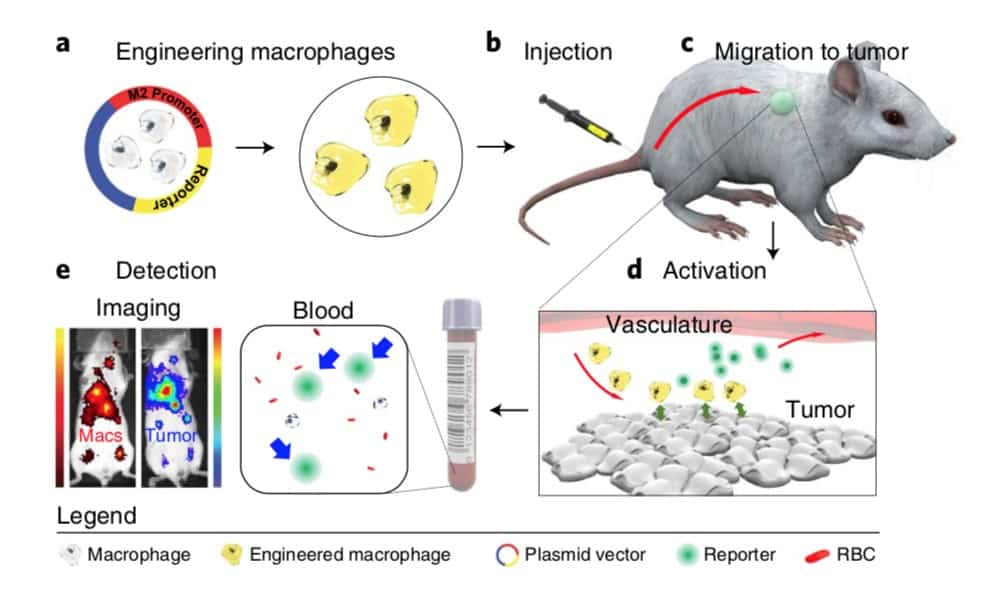
Un gruppo di ricercatori della Stanford University School of Medicine ha messo a punto un nuovo metodo per diagnosticare precocemente il cancro. Lo studio è stato pubblicato il…

La speranza è l’ultima a morire e questo ragazzo, in tal senso, rappresenta un gran esempio. Lorenzo Farinelli era un giovane medico di Ancona, che…

“Immunità e salute: sfide, dal cancro ai vaccini”, questo il titolo della Lectio magistralis che il Professor Alberto Mantovani, Direttore Scientifico di Humanitas, Accademico dei…

Ettore Castronovo, radiologo e scienziato messinese, è conosciuto per le sue ricerche sull’impiego dei raggi x nella lotta ai tumori. Primogenito di tre fratelli, nasce…
Correva l’anno 2000 quando, sulle pagine de La Repubblica, nei primi giorni di ottobre, compariva l’ennesimo articolo sulla fuga di cervelli italiani all’estero. Forse, il…
Piccoli passi possibili: sono quelli che, progressivamente, l’immuno-terapia oncologia sembra capace di compiere nella lotta al tumore. Si può facilmente consultare sulla rivista “Nature”, l’esito…
Recentemente un dipendente di Telecom si è ammalato di neurinoma, un tipo di tumore benigno a carico del sistema nervoso. Purtroppo una volta sottopostosi all’asportazione…
La caratteristica più bella della Scienza è la sua continua evoluzione. Grazie al suo efficace metodo è riuscita a descrivere ed analizzare gran parte della natura che ci circonda. Tuttavia metodo ed…