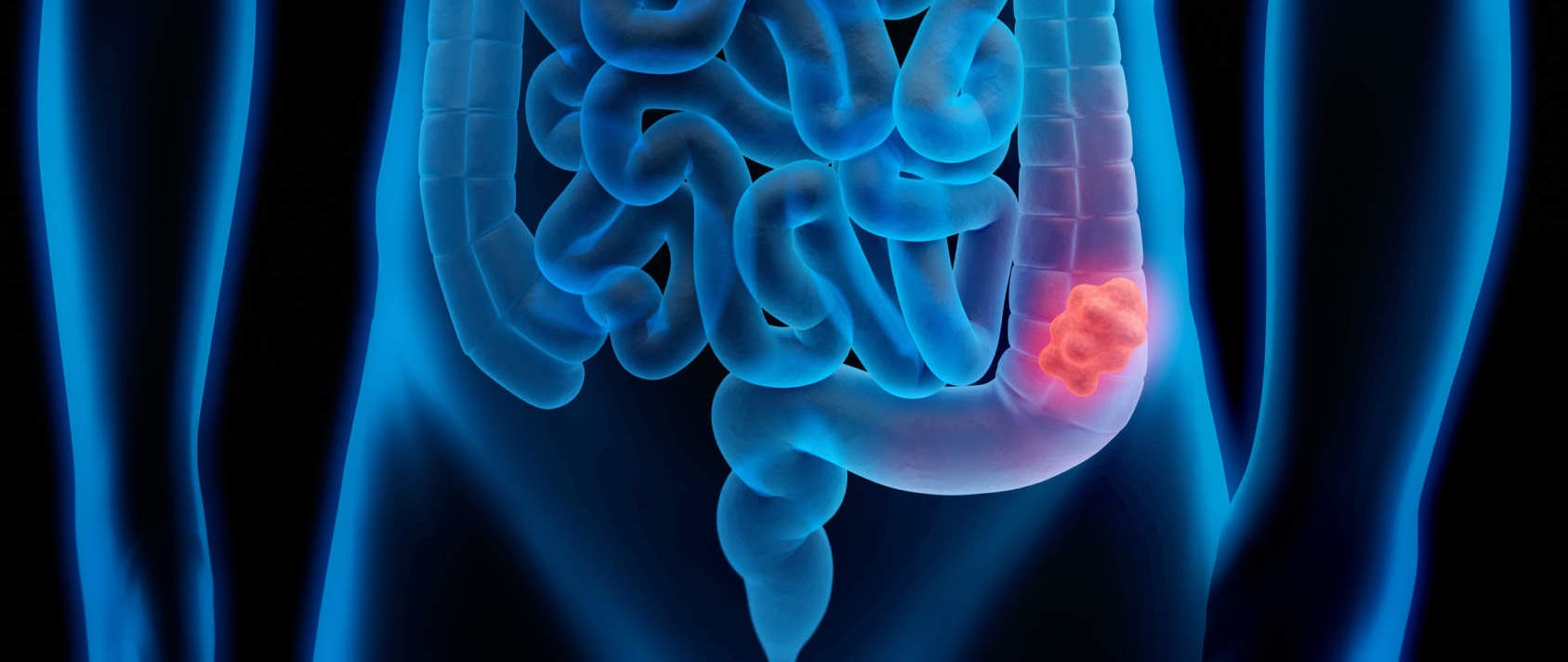
Rettocolite Ulcerosa: il ruolo della prevenzione
La RCU (rettocolite ulcerosa) è una malattia infiammatoria cronica che colpisce l’intestino crasso, in particolare il colon e il retto. Rientra nel gruppo delle malattie…



La RCU (rettocolite ulcerosa) è una malattia infiammatoria cronica che colpisce l’intestino crasso, in particolare il colon e il retto. Rientra nel gruppo delle malattie…
Recentemente nel campo dell’oncologia sono stati introdotti dei nuovi promettenti farmaci detti “agnostici“. Come funzionano? Qual è la differenza rispetto agli altri farmaci attualmente in…

Spesso le parole nucleare o radiazioni ci fanno paura e vengono viste con scetticismo nell’immaginario collettivo. La scienza ci dice tuttavia che sono dei fedeli…
E’ possibile prevedere l’insorgenza del cancro? Fattori di rischio e insorgenza di cancro Il cancro è una malattia genetica? Età: un possibile fattore predittivo? Cell…

l Nobel per la Chimica quest’anno è stato “vinto a parimerito” dalla chimica americana Jennifer A. Doudna e dalla biochimica francese Emmanuelle Charpentier, per lo sviluppo di CRISPR Cas9, una tecnica di editing…
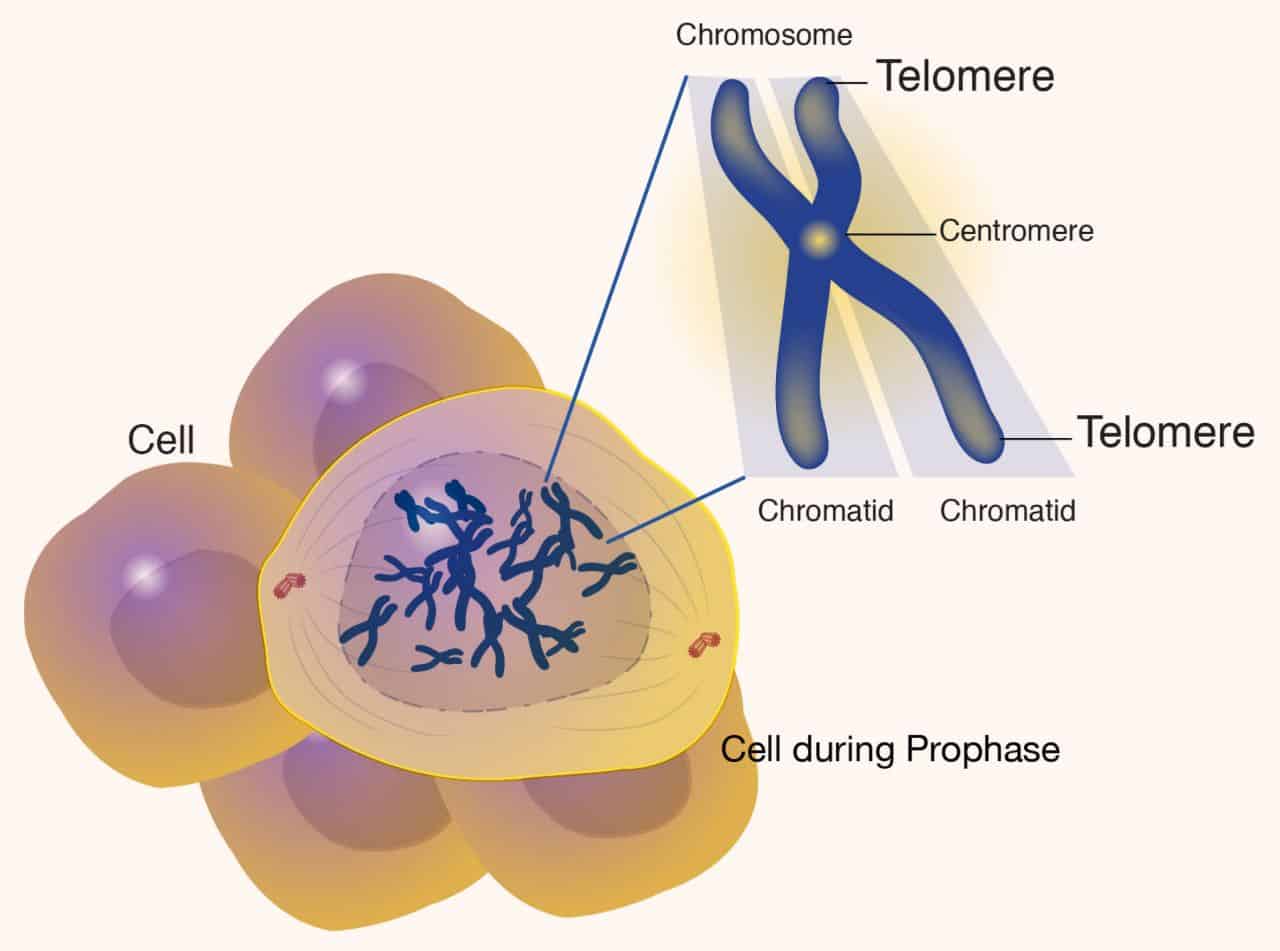
Progresso tecnologico e speranze future per le patologie incurabili. Un team di scienziati statunitensi e britannici ha prodotto la sequenza di DNA senza interruzioni, dall’inizio…

Ennesima teoria complottista associa la tecnologia 5G al COVID-19, ma il mondo scientifico smentisce Fra le varie teorie complottiste, non poteva di certo mancare un…

L’estate è ormai iniziata da molto, almeno secondo il calendario, la sessione estiva è terminata da poco e, che sia andata bene o male, ormai…
<< […] O chiusi in questo legno si tengono nascosti Achei, o questa macchina è fabbricata a danno delle nostre mura, per spiare le case…