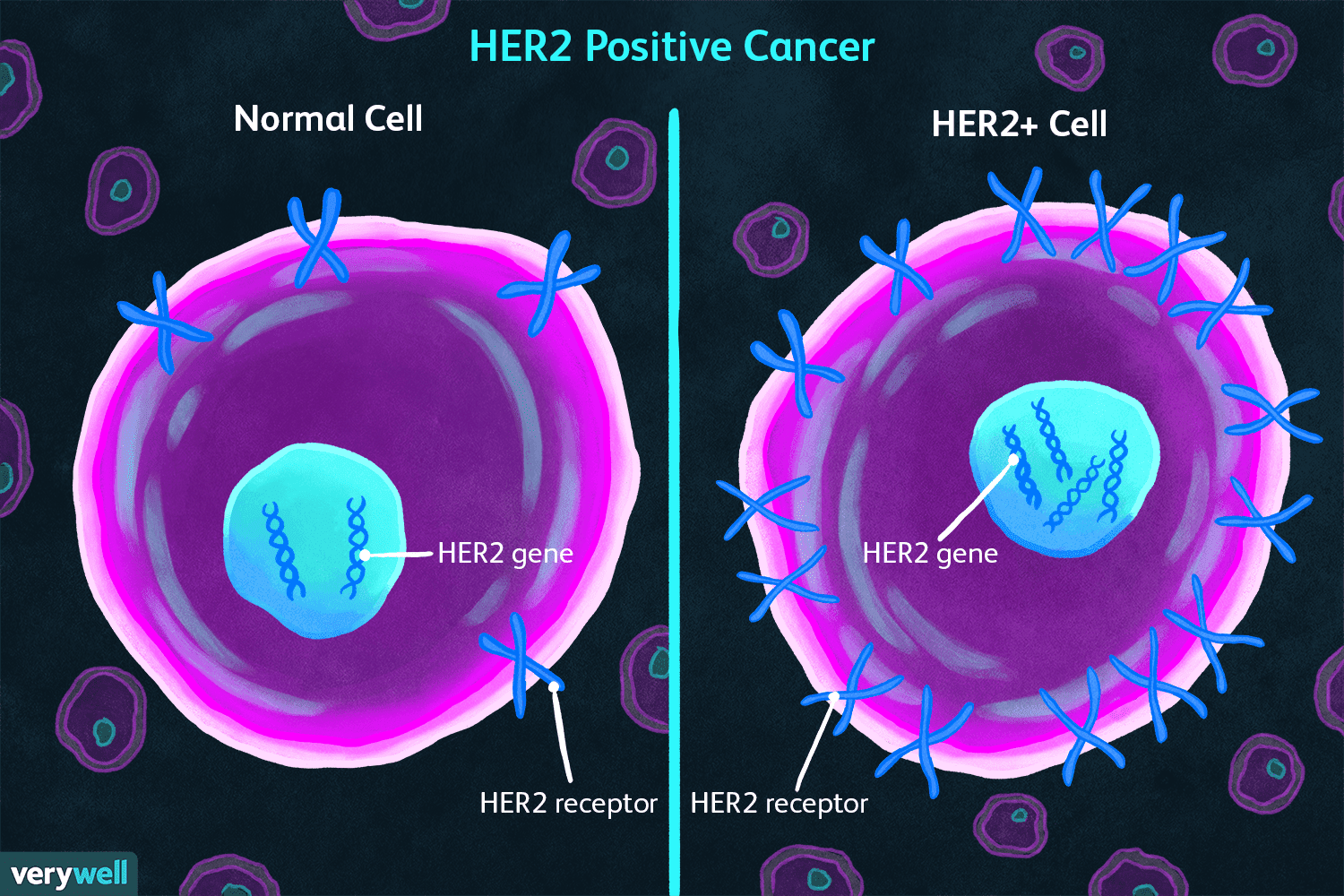
Dagli studenti per gli studenti: il recettore HER-2 e il suo ruolo nei tumori
Il recettore HER-2 (Human Epidermal Growth Factor Receptor 2) è un recettore transmembrana che fa parte della famiglia dei recettori epidermici dei fattori di crescita,…



Il recettore HER-2 (Human Epidermal Growth Factor Receptor 2) è un recettore transmembrana che fa parte della famiglia dei recettori epidermici dei fattori di crescita,…

Recentemente la corsa al vaccino anti-SARS-CoV2 sembra aver ricevuto un’accelerata decisiva: in studi di fase tre, i due sieri delle case farmaceutiche americane Pfizer e…

L’emicrania è un disordine neurobiologico primario di notevole impatto sociale ed economico. Fa parte delle cefalee primarie, insorge senza una causa organica chiaramente identificabile, nessuna…
Cosa si intende per tumore? Se cerchiamo in un qualsiasi dizionario troveremo la classica definizione: processo morboso di un organo caratterizzato da un aumento del…