
Italia, AIFA rende gratuite le pillole anticoncezionale e anti HIV
Solo pochi giorni fa, il Comitato prezzi e rimborsi (cpr) dell’Agenzia italiana del farmaco (AIFA) ha approvato la decisione di rendere gratuita la pillola anticoncezionale…



Solo pochi giorni fa, il Comitato prezzi e rimborsi (cpr) dell’Agenzia italiana del farmaco (AIFA) ha approvato la decisione di rendere gratuita la pillola anticoncezionale…

Gli anni ’80 li conosciamo grazie a film come Flashdance, Stand By Me, Karate Kid e tanti altri che ci hanno fatto sognare e…
Da due anni a questa parte l’emergenza Covid ha costretto a mettere in secondo piano ogni altra patologia infettiva e di altra natura, ha obbligato…
Era il 1981 quando si registrarono alcuni decessi per polmoniti interstiziali tra la comunità omosessuale negli USA. Due anni più tardi i ricercatori isolarono per…
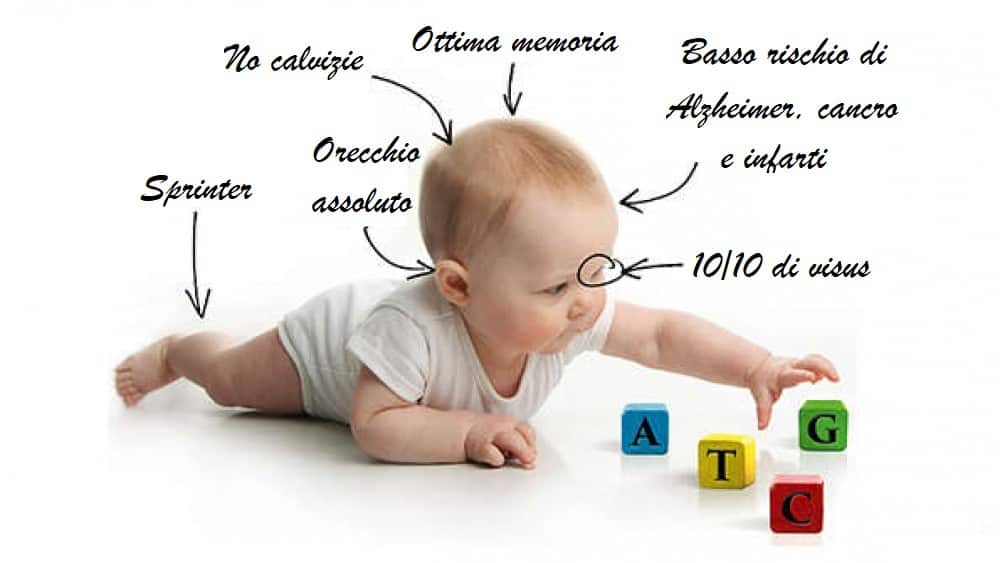
La settimana scorsa He Jiankui, ricercatore presso l’Università di Scienza e Tecnologia di Shenzen, ha dichiarato riuscita la nascita di due gemelle, Lulu e Nana, i…
Kamel Khalili, questo il nome del ricercatore che, con il suo team della Temple University di Philadelphia, inaugura un nuovo capitolo nella storia della lotta all’AIDS:…