Avrete sicuramente tenuto in mano almeno una volta delle conchiglie o visto dei coralli. Sebbene ci sembrino affascinanti, ciò che le costituisce è banalmente carbonato di calcio (CaCO3). Ciò di cui andramo a parlare, è il forte legame che c’è tra questa molecola e il surriscaldamento globale. Sorprendentemente il motivo è da ricondursi all’acqua dei mari e, in generale, a tutti i corpi d’acqua disseminati nel globo.
Indice dei contenuti
- Anche i coralli non se la vedono bene
- Perché la colpa è di quel 1,5°C in più?
- La CO2 come il prezzemolo
- È tutta questione di equilibri
- Ci stanno anche “equilibri tampone”
Anche i coralli non se la vedono bene
Partiamo da una parentesi sui coralli. Avete presente quelle splendide creature che assumono svariati colori nei fondali marini? Sarebbe un peccato se perdessero il loro colore, giusto? Ebbene, il surriscaldamento globale sta portando al loro completo sbiancamento, negli ultimi 30 anni i biologi hanno verificato una diminuzione del 50% di coralli colorati nella famosissima Grande Barriera Corallina (coste al nord-est dell’Australia). Questo è legato al pH (un parametro utilizzato in tutto il mondo per indicare l’acidità di un liquido) che negli ultimi decenni è sceso drasticamente: questo significa che l’acqua degli oceani sta diventando sempre più acida.

Perché la colpa è di quel 1,5°C in più?
I sistemi acquatici, in cui abitano conchiglie e coralli, sono tra i più complessi e articolati, le reazioni chimiche che avvengono in ogni istante sono innumerevoli e basterebbe una minima variazione della temperatura per stravolgere gli equilibri chimici che si instaurano al loro interno. Perché, però, una temperatura più alta dovrebbe rendere più acida l’acqua? Per spiegare questo dobbiamo spostarci su un altro parametro fondamentale: la solubilità.
La CO2 e le conchiglie
Ebbene sì, anche qui si parla di anidride carbonica. Sappiamo bene che la sua concentrazione nell’aria è aumentata e questo, combinato all’innalzamento delle temperature, non fa altro che aumentare la sua concentrazione nelle acque, sostituendosi all’ossigeno libero nell’acqua. Questo causa problemi alla respirazione degli animali acquatici e di conseguenza la moria delle creature più sensibili (non sopravvivono se l’ossigeno non è almeno 5 ppm o milligrammo di Ossigeno per chilogrammo di acqua marina); per giunta i corpi esanimi di queste creature si decompongono nei fondali consumando altro ossigeno.

C’è un altro problema, l’ossigeno che torna in acqua dall’atmosfera è un processo lento. Concluso il discorso sulla solubilità della CO2 che influenza quella dell’ossigeno O2 torniamo a parlare di carbonato di calcio.
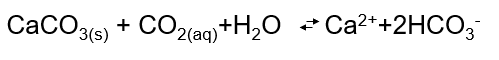
È tutta questione di equilibri
Se è vero che sta scendendo il pH, allora questa acidità dovrebbe “sciogliere” con un po’ più di forza i corpi solidi, e infatti è così. Tutte le specie chimiche carbonatiche sono rese più solubili, e gli ioni Ca2+ liberi in acqua aumentano. Nel caso di acque a contatto con molti materiali carbonatici (dovuti a sedimenti, conchiglie, minerali, rocce, ecc) avremo pH pari a 9,9
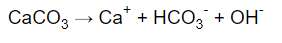
Mentre un’acqua che ha assorbito dall’atmosfera una quantità rilevante di anidride carbonica darà un pH più acido che si aggirerà a 8,29.
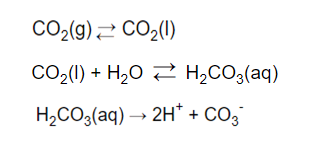
Notiamo quindi che nel popolo di specie chimiche si va ad aggiungere lo ione carbonato (CO3—) dato non solo dai corpi solidi di cui abbiamo già parlato, ma anche dall’anidride carbonica stessa. La CO2 ha vitale importanza nei sistemi acquatici, dopo essersi convertita nello ione CO3—, in quanto questo è tra le risorse primarie di cui le alghe fanno uso per crescere.
Esistono anche “equilibri tampone”
In ogni caso, i corpi d’acqua marini non sono sistemi semplici – come abbiamo già detto – e in questi vi sono delle reazioni che contrastano l’acidità generata da agenti esterni a loro stessi. Questa capacità di neutralizzare gli acidi è determinabile da un parametro chiamato alcalinità. Si può determinare da misurazioni analitiche che sommano tutte le specie chimiche che neutralizzano i composti acidi. Stiamo parlando di tutti quei composti dalla debole e forte basicità (potremmo dire che basico è un composto che fa salire il pH di una soluzione), come: gli ioni carbonato CO3—, ioni bicarbonato HCO3–, ioni idrossido OH–; e sottraendo a questi, le concentrazioni di tutti i composti acidi presenti nel corpo d’acqua. È chiaro però che questi sistemi possano funzionare fino ad un certo punto, la capacità “autopurificante” dei mari dipende da una serie di fattori che non sono artificialmente controllabili.
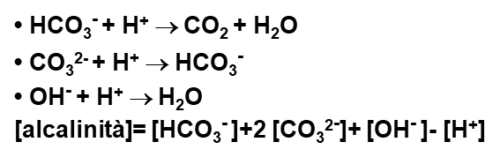
Abbiamo quindi compreso come gli equilibri cambiano per piccole variazioni come la semplice temperatura o la concentrazione di CO2. L’ossigeno disciolto in acqua che diminuisce comporta a materiale organico che richiama altro ossigeno per decomporsi che a sua volta genera altra CO2. Quest’ultimo è dato anche dal contributo atmosferico la cui situazione sappiamo non essere rosea.
Salvatore Donato
Bibliografia
S. E. Manahan, Chimica dell’Ambiente, Piccin 2000
