Le proprietà fotocatalitiche del TiO2 possono rivoluzionare il settore rinnovabile, grazie alle loro capacità di decontaminazione
Al giorno d’oggi, una delle più grandi sfide che il mondo si trova ad affrontare è il passaggio da uno sfruttamento intensivo delle risorse terrestri ad un utilizzo “green” di ciò che la Terra ci offre.
Così il mondo della ricerca ha ideato vari dispositivi per sfruttare le energie rinnovabili, quali celle solari (delle quali abbiamo parlato in un precedente articolo), pale eoliche, reattori nucleari, ecc. Ma una conversione green passa anche attraverso la pulizia dell’acqua che utilizziamo e dell’aria che respiriamo.
Per venire incontro a queste esigenze, gli scienziati si sono affidati ai materiali fotocatalitici. Cosa sono? E soprattutto, cos’è la fotocatalisi?
La fotocatalisi
La fotocatalisi, secondo la Treccani, è “l’azione in virtù della quale alcuni materiali semiconduttori […] sotto l’azione della luce possono dar luogo a reazioni di riduzione o di ossidazione di sostanze indesiderate presenti anche in piccole quantità”.
Può anche essere definita come l’accelerazione della velocità di processo di una fotoreazione per la presenza di un catalizzatore (materiale che modifica la velocità di una reazione chimica, senza rientrare nei prodotti finali).
Un fotocatalizzatore, nella fattispecie, diminuisce l’energia di attivazione di un determinato processo, in modo che sia più semplice che inizi.
La fotocatalisi eterogenea avviene quando scegliamo come sistema fotocatalizzatore un insieme di particelle di semiconduttore aventi proprietà fotocatalitiche, poste a contatto con l’acqua o il gas con i quali vogliamo che reagiscano. Quando il fotocatalizzatore viene esposto alla luce, vengono generati degli stati eccitati capaci di dare il via a reazioni redox o trasformazioni molecolari.
Cosa avviene nel dettaglio?
Ricordando la struttura a bande dei semiconduttori (che abbiamo spiegato nel precedente articolo), quando un fotone di energia superiore all’energy gap colpisce il semiconduttore, viene prodotta una coppia elettrone – lacuna, con l’elettrone che passa quindi dalla banda di valenza alla banda di conduzione. Nei semiconduttori alcune di queste coppie elettone fotoeccitato – lacuna diffondono sulla superficie della particella catalitica, prendendo parte alla reazione chimica con le molecole assorbite: donatore o accettore.
Uno dei più utilizzati e promettenti semiconduttori, avente una forte attività fotocatalitica (grazie all’assorbimento diretto di fotoni, può partecipare a reazioni chimiche di superficie), è il biossido di Titanio (TiO2), o più semplicemente la Titania. Possiede infatti delle proprietà uniche:
- Alto indice di rifrazione e alto grado di trasparenza nella regione dello spettro visibile, che lo rendono ideale nell’energy storage, nonostante assorba solo il 5% della radiazione solare incidente;
- alta porosità;
- alta affinità superficiale;
- bassi costi e facile produzione in grandi quantità (che lo rendono quindi scalabile per le aziende);
- inerzia chimica;
- non tossicità;
- biocompatibilità.
La Titania si presenta in 3 forme cristalline (rutilo e anatasio, le quali sono le forme più diffuse in natura, e la brookite) e in fase amorfa. La fase rutilo è più stabile rispetto all’anatasio, ma la seconda possiede una maggiore attività fotocatalitica.
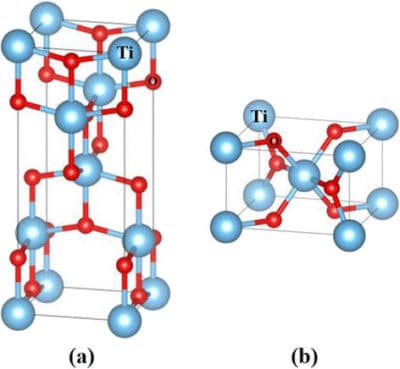
Nell’immagine possiamo vedere le strutture delle fasi a) anatasio e b) rutilo
Ma quali applicazioni ha il TiO2?
DECONTAMINAZIONE
Abbiamo detto che, se un fotone ha una energia maggiore dell’energy gap, produce una coppia elettrone-lacuna.
Una delle caratteristiche degli ossidi dei metalli semiconduttori è il forte potere ossidante delle loro lacune. Queste possono, ad esempio, reagire con l’acqua assorbita sulla loro superficie: si ha così la formazione di un radicale ossidrile molto reattivo (OH). Lacune e gruppi ossidrili possono ossidare la maggior parte dei contaminanti organici, riuscendo così a decontaminare l’acqua.
Quando una molecola di ossigeno presente nell’aria reagisce con un elettrone, invece, si comporta come accettore di elettroni per formare uno ione super-ossido, particelle fortemente reattive capaci di ossidare materiali organici inquinanti.
Queste due applicazioni rendono il TiO2 ideale per l’applicazione nella decontaminazione di acqua e aria.
PRODUZIONE DI MATERIALI AUTOPULENTI
Uno strato sottilissimo di Titania è utilizzato anche come copertura nelle lastre di vetro. Quando un fotone incidente colpisce questo strato di TiO2 si producono, come è noto, elettroni e lacune. Attraverso i meccanismi precedentemente descritti, molte sostanze organiche adsorbite dalle superfici vengono decomposte e, grazie all’idrofilia foto-indotta, vengono fatte scorrere dall’acqua sulle superficie, che porta con sé i materiali inquinanti.
La caratteristica idrofila della superficie avviene grazie alle reazioni redox che avvengono a seguito della irradiazione di fotoni. In questo processo viene espulso ossigeno, creando quindi una vacanza. Queste vacanze vengono colmate dall’acqua producendo gruppi ossidrilici adsorbiti e quindi siti idrofili superficiali, mentre il resto della superficie mantiene caratteristiche idrofobiche. Maggiore è l’esposizione alla radiazione solare, maggiori saranno i siti idrofili che si formeranno. L’acqua piovana, quindi, tenderà a formare un fil continuo, piuttosto che raccogliersi in gocce, rendendo più facile il trasporto di inquinanti.

Fonte: Tribuna di Treviso
ABBATTIMENTO DELL’INQUINAMENTO CITTADINO DA NOx
Immaginiamo di dotare le pavimentazioni stradali e le pareti delle varie strutture cittadine di coperture composte da TiO2. I gas inquinanti prodotti dalle automobili, come il NOx, filtrano attraverso la superficie porosa e si legano alle particelle di TiO2. Quando i fotoni incidono la Titania, vengono prodotte le solite coppie elettrone-lacuna, si ottiene la fotoattivazione e quindi la decomposizione di gas nocivi quali NO e NO2, adsorbite nelle particelle e trasformati in acido nitrico (HNO3). L’acqua piovana porta con sé quindi l’acido nitrico come ioni nitrati, del tutto innocui, oppure il carbonato di calcio alcalino contenuto nei materiali può neutralizzare l’acido. Questo processo è quindi simile a quello che avviene nelle piante e negli alberi grazie alla fotosintesi clorofilliana.

Fonte: materialidesign.it
AZIONE ANTIMICROBICA
Batteri e funghi, anche molto resistenti, come l’Escherichia coli e lo Staphylococcus, vengono decomposti grazie al forte potere ossidante della Titania. Il TiO2 è molto più forte di altri agenti antimicrobici, perché agisce anche quando le superficie sono coperte da cellule e quando i batteri si stanno attivamente propagando.
Conclusioni
Il TiO2 continua a stupire i ricercatori grazie alle sue proprietà fotocatalitiche. In futuro, un suo largo utilizzo potrebbe garantire una notevole decontaminazione di materiali inquinanti e batteri, rendendo sempre più “green” le città in cui viviamo.
Giovanni Gallo
