Ogni anno, in Italia, si verificano circa 120 mila casi di infarto miocardico acuto, il classico “attacco di cuore”. La mortalità per questo evento si aggira mediamente intorno all’11%, percentuale più bassa che in passato ma ancora molto preoccupante: si tratta della prima causa di morte nei Paesi occidentali.
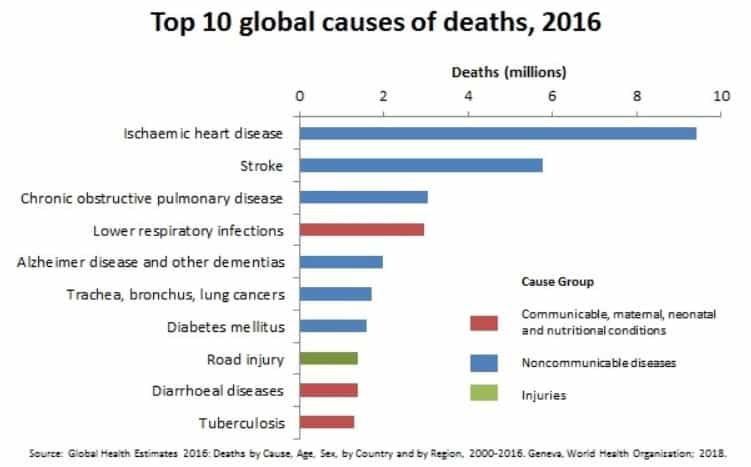
L’infarto miocardico acuto è dovuto ad una ostruzione delle arterie coronarie che impedisce il trasporto di ossigeno e nutrienti alle cellule causandone la morte. Si stima che in corso di infarto possano essere perse da 1 a 4 miliardi di cellule cardiache che, a differenza di altre, non possono rigenerarsi e vengono sostituite da tessuto cicatriziale.
L’esito è quindi una perdita permanente della capacità contrattile del cuore che predispone a una lunga serie di complicanze, anche dopo l’evento acuto, prima fra tutte lo scompenso cardiaco.
Rigenerare il tessuto cardiaco è quindi l’obiettivo principale per migliorare la funzionalità cardiaca e prevenire ulteriori rischi. Per farlo, un team guidato da ricercatori italiani dell’Icgeb (Centro internazionale di ingegneria genetica e biotecnologia) di Trieste e della Scuola Superiore Sant’Anna di Pisa ha utilizzato la terapia genica. I risultati sono stati pubblicati sulla prestigiosa rivista Nature.

L’idea nasce dall’osservazione che molte specie animali come pesci e salamandre, in caso di danno muscolare, producono specifici microRNA (miRNA), piccole porzioni di RNA a singolo filamento capaci di modulare l’attività di alcuni geni. Diversi studi hanno dimostrato, ad esempio, che nel modello animale di Zebrafish alcuni miRNA portano alla riparazione del cuore danneggiato dall’infarto. Altre ricerche hanno perfino rivelato che alcuni miRNA umani possono stimolare la rigenerazione delle cellule cardiache nel topo infartuato. Ciò però non accade fisiologicamente nell’uomo.
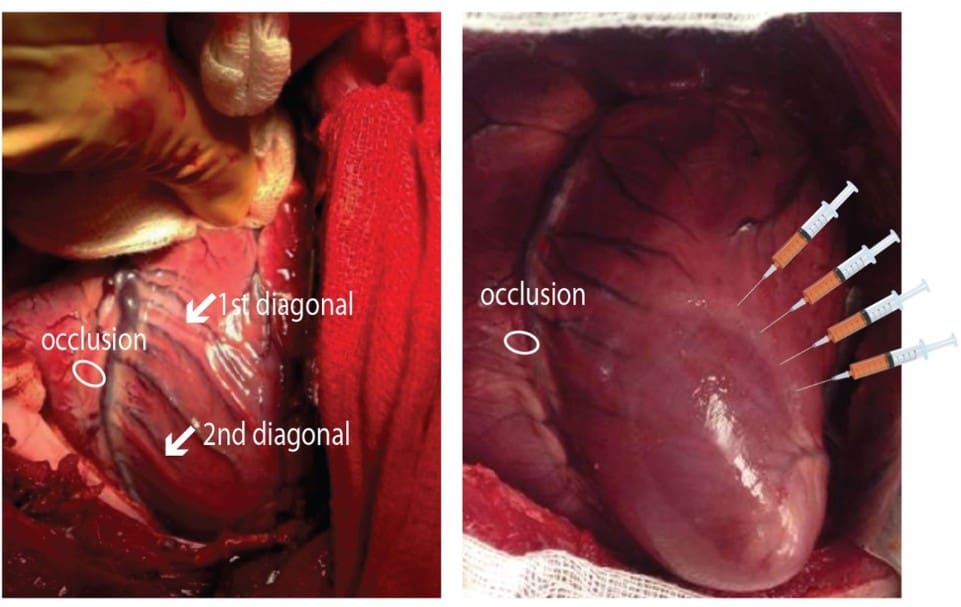
I ricercatori hanno quindi sperimentato se questo meccanismo fosse efficace nel maiale, modello clinicamente rilevante di grande mammifero, con un apparato cardiovascolare molto simile a quello umano. La molecola protagonista dello studio è il microRNA-199a, di origine umana. Per veicolare questa molecola nei miocardiociti dei maiali è stato sfruttato, con tecniche di ingegneria genetica, un particolare virus (virus adeno-associato di tipo 6), dentro il quale è stato trasferito il miRNA.
La tecnica prevede poi che il virus, di per sé innocuo, sia inserito nei miocardiociti, dove permette l’azione del miRNA.
A partire da un gruppo di 25 maiali, in ognuno di essi è stata indotta l’occlusione per 90 minuti di un’arteria coronaria, in modo da generare un infarto; dopo di che, il flusso sanguigno è stato ristabilito. I maiali infartuati sono stati quindi divisi in due gruppi:
- Il primo gruppo ha ricevuto il virus vettore del miRNA-199a;
- Il secondo gruppo è stato trattato invece con il virus “vuoto” ed è servito come controllo.
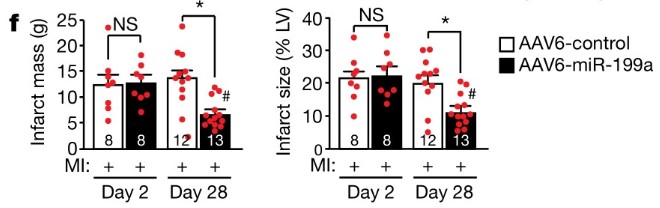
Due giorni dopo la procedura, le dimensioni della massa infartuata sono risultate invariate in entrambi i gruppi. Tuttavia, quattro settimane dopo, al 28° giorno, il tessuto cicatriziale nei maiali trattati con il miRNA si è ridotto di oltre il 50%. Ulteriori esami con risonanza magnetica cardiaca (cMRI) hanno inoltre dimostrato un importante recupero funzionale del cuore, con un incremento sostanziale della gittata cardiaca.
Per avere ulteriori conferme, i ricercatori hanno studiato i miocardiociti con tecniche di biologia molecolare, e hanno dimostrato la presenza di Ki67 ed altri markers specifici di riparazione e proliferazione. Nell’insieme, questi risultati hanno rimosso ogni dubbio sull’azione rigenerativa mediata dal miRNA-199a tramite la regolazione dell’espressione genica.
Dato ancor più importante è che le cellule in attiva moltiplicazione hanno mantenuto il contatto reciproco necessario per una corretta contrazione e per la trasmissione dell’impulso elettrico. Inoltre, non è stata rilevata l’espressione di alcuna molecola patologica (come ad esempio la β-miosina fetale, che si ritrova in caso di scompenso cardiaco).
Questi risultati, anche fin troppo promettenti, sono stati però seguiti dalla morte improvvisa, senza alcun segno premonitore, di gran parte dei maiali trattati. In tutti i casi, dopo circa 7-8 settimane, si sono verificate delle aritmie cardiache fatali.
L’unica spiegazione plausibile a questi eventi è che l’intensa proliferazione dei miocardiociti, non uniforme nell’intero tessuto cardiaco, faciliti la formazione di circuiti di rientro. Si tratta di circuiti elettrici anomali all’interno del cuore che impediscono la trasmissione fisiologica, in un solo senso, dell’impulso elettrico, innescando una sorta di “micro-cortocircuito” che porta ad aritmie o, nei casi più gravi, ad arresto cardiaco.
Questo effetto a lungo termine, come affermato dagli studiosi, è essenzialmente dose-dipendente, causato dall’impossibilità, attraverso l’iniezione di un virus, di controllare in modo preciso il dosaggio del miRNA. Il passo successivo, già eseguito sui topi, è l’utilizzo dei cosiddetti “miRNA mimics”, ovvero molecole sintetiche che possono essere dosate ed utilizzate come fossero un vero e proprio farmaco.
I ricercatori hanno iniziato a testare questa tecnica di somministrazione nei maiali e sono fiduciosi di ottenere i primi risultati entro 6 mesi. Se tutto andrà bene, entro 5 anni potrà essere già conclusa la sperimentazione clinica sull’uomo.
Davide Arrigo
Bibliografia:
https://www.nature.com/articles/s41586-019-1191-6
